
Etudes observationnelles et essais cliniques
10 ans* : c’est le temps qu’il faut en moyenne pour développer un nouveau médicament. Car avant de devenir un médicament, les molécules qui présentent un intérêt potentiel doivent passer de nombreuses phases de test rigoureuses.
*Source : Leem
Les études observationnelles
Les études observationnelles constituent une part essentielle de la recherche en santé publique et en sciences sociales. Elles sont des outils puissants pour comprendre les déterminants des états de santé, orienter les politiques publiques et alimenter les essais interventionnels.
Lors d’une étude observationnelle, le chercheur observe et enregistre des informations sur des personnes, des événements ou des comportements sans intervenir ni attribuer de traitements. Ces informations sont collectées pour analyser des associations entre facteurs et résultats, sans modifier la situation du patient, pour mieux comprendre une maladie ou l’efficacité d’un médicament par exemple.
Ces études sont essentielles pour obtenir le ressenti des patients sur leur traitement et leur maladie.
Méthodologie d'une étude observationnelle
Avant tout, la question de recherche et l’objectif de l’étude sont clairement définis : nous choisissons le type d’étude observationnelle le plus adapté (transversale, cohorte, cas‑témoin, etc.), précisons quel type de patients sera inclus et comment ils seront recrutés, calculons la taille de l’échantillonnage nécessaire, définissons précisément les expositions, les résultats et les facteurs confondants, et préparons des outils de collecte (questionnaire, dossier, mesures).
Nous préparons alors la mise en place de la collecte et le stockage sécurisé des données avec des contrôles qualité en respectant les exigences éthiques et réglementaires (consentement, confidentialité) et rédigeons un protocole préenregistré.
Nous prévoyons ensuite les méthodes statistiques pour décrire la population et estimer les associations en ajustant les confondeurs. Enfin, nous interprétons les résultats avec prudence en mentionnant les limites, et diffusons les conclusions.
Vous trouverez notre notice d’information collective sur les traitements des données personnelles dans le cadre de recherches, d’études et d’évaluations dans le domaine de la santé, ainsi que le tableau des études observationnelles et évaluations menées par MSD France en cliquant ici.
Les différentes étapes d’un essai clinique
Avant de recevoir leur autorisation de mise sur le marché dans une maladie, les médicaments et vaccins en développement passent par une phase de tests systématique et rigoureuse et subissent ainsi un processus d’évaluation sur des volontaires (ou des patients, en fonction de la pathologie étudiée). Ce processus a pour objectif de déterminer si un nouveau produit peut recevoir une autorisation d’utilisation sur une population plus importante.
L’étude clinique permet d’évaluer la sécurité et l’efficacité d’un médicament. Dans certains cas, elle permet aussi à des patients d’accéder de manière plus précoce à des traitements prometteurs et de leur apporter un espoir de vie.
Chaque essai clinique est conçu afin de répondre à certaines questions de la phase de recherche. Un protocole strict, prédéfini, est suivi afin de garantir des résultats sûrs et précis. Chaque phase du développement d’un médicament ou d’un vaccin est associée à un objectif différent.
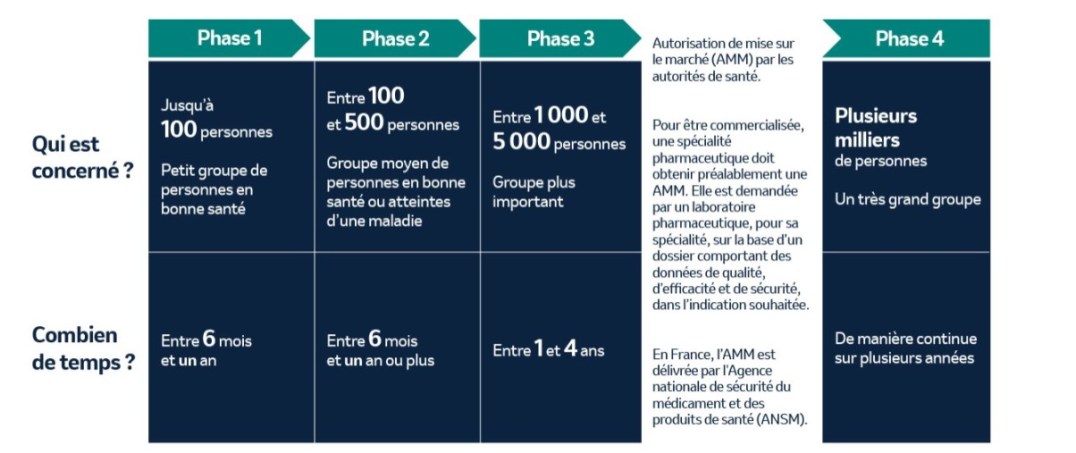
Phase I
Les chercheurs testent pour la première fois un traitement ou un médicament expérimental sur un petit groupe de volontaires sains (moins de 100 personnes) afin de suivre le parcours de la molécule dans l’organisme en fonction du temps et de commencer à identifier les effets indésirables.
Phase II
Le médicament ou le traitement en cours d’étude est administré à un groupe plus important de volontaires atteints de la maladie (100 à 500 personnes) afin de déterminer la tolérance et l’efficacité de la molécule. Une première étape permet de déterminer la dose minimale efficace, pour laquelle les effets indésirables sont inobservables ou minimes. Dans un second temps, cette dose sera administrée à 100 à 300 patients (dans la mesure du possible, selon la fréquence de la pathologie ciblée) pour rechercher un bénéfice thérapeutique. Si les données recueillies démontrent qu’un effet thérapeutique est obtenu et que la balance bénéfice-risque est considérée comme en faveur du médicament, le médicament peut passer à l’étape suivante.
Phase III
Cette phase de l’essai clinique teste un candidat médicament sur un nombre encore plus important de patients atteints de la maladie (1 000 à 5 000 personnes). Une évaluation plus approfondie de l’efficacité du médicament est réalisée, ainsi qu’un suivi des effets indésirables. Dans certains cas, ce candidat sera comparé à un traitement de référence, si un tel traitement est déjà disponible. A l’issue de ces essais, et en fonction de leurs résultats, les autorités sanitaires délivrent ou non une autorisation de mise sur le marché (AMM) au médicament testé.
Phase IV
Une fois l’approbation d’un médicament ou d’un traitement par les agences gouvernementales et réglementaires concernées, sa commercialisation peut avoir lieu. Nous continuons, dès lors, à étudier son efficacité et sa sécurité sur une durée plus longue et sur un nombre plus important d’individus. Nous pouvons également poursuivre l’étude de certains de nos produits déjà commercialisés et entamer des recherches pour de nouvelles indications. En règle générale, des milliers de patients participent aux essais cliniques de phase IV.

Quelles sont les étapes clefs de l’accès au marché des médicaments ?
Dans cette vidéo, plongez dans le long parcours qui permet l’accès au marché des médicaments, de l’obtention de l’autorisation de mise sur le marché (AMM) à sa mise à disposition pour les patients.
MSD France et les essais cliniques
Nous organisons et coordonnons sur le territoire les essais cliniques pour les candidats vaccins et médicaments mis au point par le groupe MSD, afin de déterminer s’ils peuvent être soumis aux autorités de santé et obtenir une autorisation de mise sur le marché.
Les nombreux collaborateurs impliqués dans ce processus permettent la mise en place d’essais cliniques de qualité, et ainsi d’entretenir une confiance réciproque entre les acteurs de la recherche clinique, les patients et MSD.
études cliniques en cours sur le territoire français
patients inclus dans l’un de nos essais cliniques en France
centres partenaires sur le territoire
L’expérience patient au cœur de l’innovation thérapeutique
Depuis 2019, en oncologie comme dans le VIH, des documents d’information à destination des patients dans le cadre des essais cliniques sont soumis à un examen systématique auprès de comités de patients. L’objectif de cette démarche est d’améliorer l’information délivrée aux patients.
FR-CMM-00690 – Juillet 2024

