Recherche clinique
MSD a depuis toujours comme credo de concentrer les efforts de ses équipes de recherche sur les enjeux de santé publique les plus pressants, pour répondre aux besoins médicaux non satisfaits et améliorer la vie des patients. Nous investissons ainsi massivement dans la recherche de pointe pour une innovation engagée, exigeante et ciblée.
Notre R&D en chiffres
pays contributeur aux essais cliniques de MSD au niveau mondial
patients français inclus dans nos essais cliniques
études cliniques de phase I à IV
Le pari d’un avenir tourné vers encore plus d’innovations
La recherche clinique est le premier moyen pour les patients d’accéder à l’innovation thérapeutique. Les hommes et les femmes de MSD travaillent sans relâche pour mener avec sécurité, qualité et conformité, les essais cliniques qui permettront la mise à disposition de nos médicaments et vaccins de demain. Pour concevoir des innovations thérapeutiques capables de changer la donne dans la prise en charge de pathologies à forts enjeux de santé publique, MSD intègre à son modèle de R&D une écoute des besoins des patients et des praticiens.

Découvrez le moteur de recherche d’essais cliniques de MSD France
Acteur engagé dans la recherche et pionnier dans le développement de traitements et vaccins innovants, MSD France souhaite améliorer l’accès à l’information sur les innovations. Nous avons ainsi développé un moteur de recherche permettant à tous d’accéder à l’ensemble des essais cliniques MSD en cours dans sa région.

Comment une molécule devient-elle un médicament ?
Le saviez-vous ? Sur 10 000 molécules présentant un intérêt potentiel, 1 seule deviendra un médicament. Découvrez toutes les étapes de son développement dans cette vidéo.

Quelles sont les étapes clés de l’accès au marché des médicaments ?
Dans cette vidéo, plongez dans le long parcours qui permet l’accès au marché des médicaments, de l’obtention de l’AMM à sa mise à disposition pour les patients.

Pipeline
Découvrez notre pipeline de molécules et candidats vaccins

MSDAVENIR
Découvrez notre fonds de soutien à la recherche en France
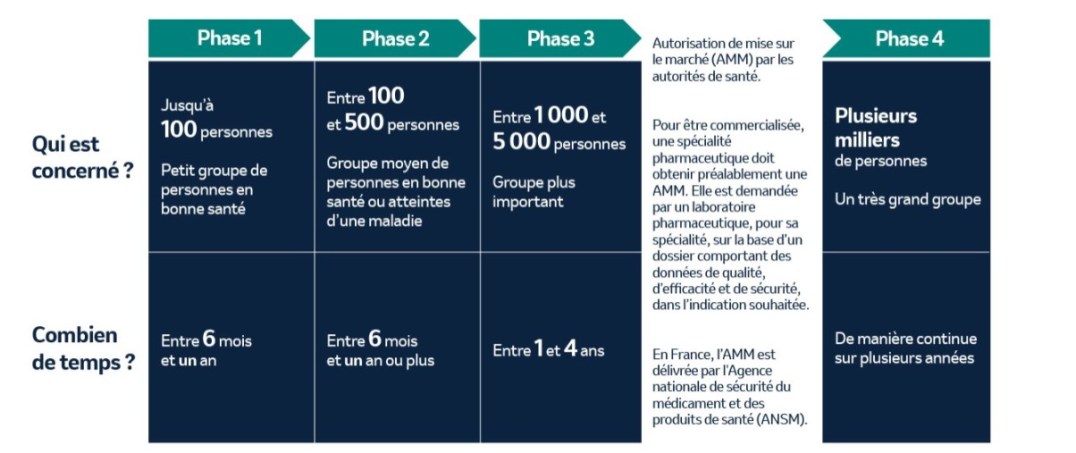
Les étapes de la recherche clinique
Avant de recevoir leur autorisation de mise sur le marché, les médicaments et vaccins en développement passent par une phase de tests systématique et rigoureuse et subissent ainsi un processus d’évaluation sur des volontaires. Ce processus a pour objectif de déterminer si un nouveau produit peut recevoir une autorisation d’utilisation sur une population plus importante.
Chaque essai clinique est conçu afin de répondre à certaines questions de la phase de recherche. Un protocole strict, prédéfini, est suivi afin de garantir des résultats sûrs et précis. Chaque phase du développement d’un médicament ou d’un vaccin est associée à un objectif différent.
Phase I
Les chercheurs testent pour la première fois un traitement ou un médicament expérimental sur un petit groupe d’individus sains (moins de 100 personnes) afin d’en évaluer la sécurité, de déterminer une posologie adaptée, de suivre le parcours de la molécule dans l’organisme et de commencer à identifier les effets indésirables.
Phase II
Le médicament ou le traitement en cours d’étude est administré à un groupe plus important d’individus atteints de la maladie (100 à 500 personnes) afin de recueillir les données préliminaires relatives à un effet thérapeutique et de réaliser une évaluation plus approfondie du profil de sécurité du médicament ou traitement. Si les données recueillies démontrent qu’un effet thérapeutique est obtenu et que la balance bénéfice-risque est considérée comme en faveur du médicament, le médicament peut passer à l’étape suivante.
Phase III
Cette phase de l’essai clinique teste un candidat médicament sur un nombre encore plus important d’individus atteints de la maladie (1 000 à 5 000 personnes). Une évaluation plus approfondie de l’efficacité du médicament est réalisée, ainsi qu’un suivi des effets indésirables. Dans certains cas, ce candidat sera comparé à un traitement de référence, si un tel traitement est déjà disponible.
Phase IV
Une fois l’approbation d’un médicament ou d’un traitement par les agences gouvernementales et réglementaires concernées, sa commercialisation peut avoir lieu. Nous continuons, dès lors, à étudier son efficacité et sa sécurité sur une durée plus longue et sur un nombre plus important d’individus. Nous pouvons également poursuivre l’étude de certains de nos produits déjà commercialisés et entamer des recherches pour de nouvelles indications. En règle générale, des milliers d’individus participent aux essais cliniques de phase IV.